En estudios anteriores, los científicos habían detectado mutaciones que hacen que las enzimas TET pierdan su función en muchos pacientes con cánceres de sangre y cánceres sólidos. Los investigadores también habían descubierto que la inestabilidad genómica, como las roturas de doble cadena en el código de ADN, son una característica común en las células cancerosas.
En este proyecto, exploraron una forma potencial en que la deficiencia de TET está relacionada con la inestabilidad genómica.
"Los investigadores encontraron que la eliminación de las enzimas TET2 y TET3 en las células B maduras tenía enormes consecuencias para la homeostasis"
Esta nueva investigación estuvo dirigida por la profesora del Instituto de Inmunología de La Jolla (LJI) Anjana Rao, del Centro LJI para la Inmunoterapia del Cáncer, y los experimentos fueron encabezados por el instructor de LJI Vipul Shukla y la estudiante graduada de UC San Diego Daniela Samaniego-Castruita.
Al estudiar un modelo de linfoma en ratones, los investigadores encontraron que la eliminación de las enzimas TET2 y TET3 en las células B maduras tenía enormes consecuencias para la homeostasis de las células B.

"Los ratones deficientes en TET desarrollaron linfoma, y observamos un aumento en las marcas asociadas con la inestabilidad genómica, como las roturas de doble cadena", afirma Samaniego-Castruita.
Sin TET2 y TET3, el ADN estaba plagado de estructuras de ADN inusuales llamadas G-quadruplexes y R-loops
Luego, el equipo realizó un análisis genómico en busca de pistas sobre lo que estaba sucediendo a nivel molecular. Vieron que sin TET2 y TET3, el ADN estaba plagado de estructuras de ADN inusuales llamadas G-quadruplexes y R-loops.
El ADN normalmente tiene dos hebras que corren paralelas entre sí, como dos rieles de una escalera. Los bucles R aparecen cuando un tercer riel, hecho de ARN, se desliza y fuerza un espacio entre los dos rieles. Los G-quadruplex actúan como nudos en éstos. Tanto los bucles R como los G-quadruplex dificultan que los dos rieles originales de ADN se "descompriman" a medida que la célula intenta leer el código de ADN y mantener la célula funcionando correctamente.
Shulka y Samaniego-Castruita examinaron estas estructuras de ADN en profundidad, gracias a la financiación de los Premios TUllie y Rickey Families SPARK del Instituto La Jolla por Innovaciones en Inmunología.
Las enzimas TET
"Estas estructuras representan sitios en el ADN que son mucho más frágiles que otras regiones", apunta Shukla. "Con este estudio, encontramos que las enzimas TET están quizás relacionadas con la regulación de estas estructuras, lo que a su vez podría explicar un mecanismo para la adquisición de inestabilidad genómica en ausencia de éstas".
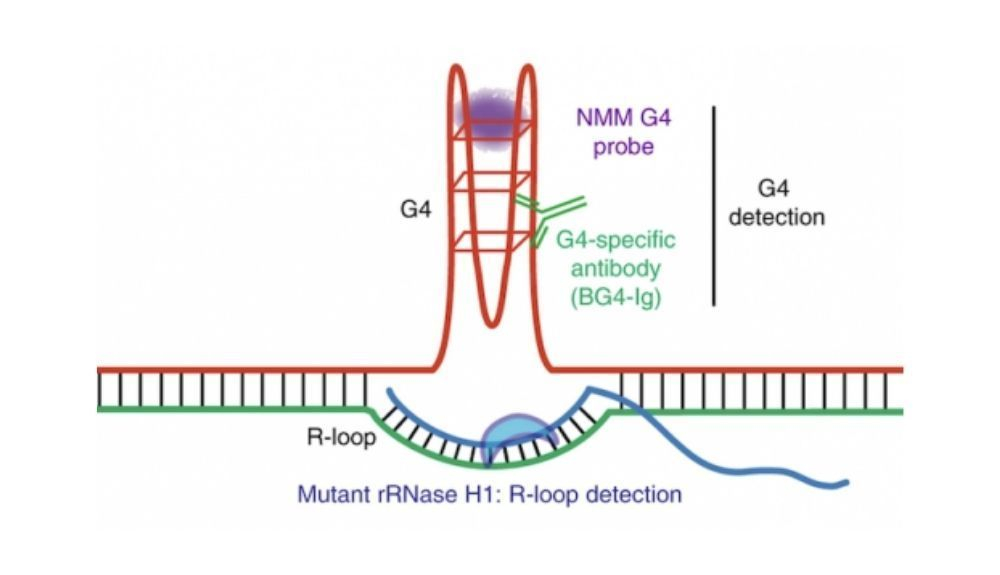
Cuando se trata de neoplasias malignas de células B, los G-quadruplexes y los R-loops parecen ser un eslabón perdido entre las mutaciones TET reveladoras y la peligrosa inestabilidad genómica.
Entonces, si los G-quadruplexes y los R-loops están causando problemas, ¿hay alguna manera de evitar que se formen?
La eliminación de DNMT1 se asoció con un retraso sorprendente en el desarrollo de linfomas agresivos de células B
Shukla y Samaniego-Castruita observaron que DNMT1 estaba regulado al alza en células B deficientes en TET. DNMT1 es una enzima clave responsable de mantener las marcas en el ADN llamada "metilación del ADN", muy importante en el genoma, y que normalmente se elimina a través de la actividad de las enzimas TET.
Sin enzimas TET, se rompió el toma y daca normal de las marcas de metilación del ADN. En su siguiente experimento, los científicos también eliminaron el gen Dnmt1 en células B deficientes en TET en ratones para probar si los niveles de cuadrupplexos G y R-loops podrían alterarse al eliminar la proteína DNMT1.

De hecho, la eliminación de DNMT1 se asoció con un retraso sorprendente en el desarrollo de linfomas agresivos de células B. También se asoció con una disminución de los niveles de G-quadruplexes y R-loops, dice Samaniego-Castruita.
Los investigadores enfatizan que la regulación de G-quadruplexes y R-loops puede ser solo una forma en que las enzimas TET controlan la estabilidad genómica. También hay más trabajo por hacer para descubrir los pasos precisos que llevan a las células deficientes en TET a acumular estas estructuras enigmáticas en el ADN.
Algún día, el equipo espera diseñar estrategias a través de las cuales los G-quadruplexes y R-loops podrían ser dirigidos para ayudar a los pacientes con cáncer.
Fuente: New Wise.