Los pensadores griegos antiguos ya creían que la materia estaba compuesta de pequeñas partículas básicas que no podían dividirse más. La ciencia tardó más de 2.000 años en avanzar lo suficiente como para demostrar que esta teoría era correcta. El viaje para comprender el átomo y su funcionamiento interno fue largo y complicado.
Fue el químico británico John Dalton quien a principios del siglo XIX revivió las ideas de los antiguos griegos de que la materia estaba compuesta de diminutas partículas indivisibles llamadas átomos. Dalton creía que cada elemento químico constaba de átomos de distintas propiedades que podían combinarse en varios compuestos, según Britannica.
Cien años después de él, los físicos comenzaron a descubrir que el átomo era, de hecho, bastante complejo por dentro
Aproximadamente, cien años después de él, los físicos comenzaron a descubrir que el átomo era, de hecho, bastante complejo por dentro.

El físico británico Joseph John Thomson hizo el primer gran avance en la comprensión del átomo en 1897, cuando descubrió que éste contenía pequeñas partículas cargadas negativamente a las que llamó electrones Pensó que éstos flotaban en una "sopa" cargada positivamente dentro de la esfera atómica, según Khan Academy .
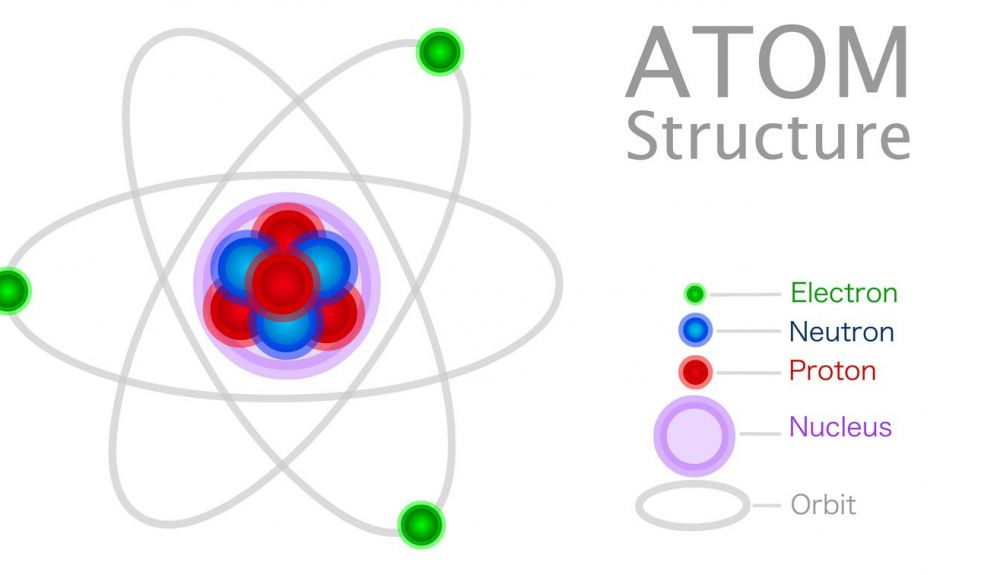
Catorce años más tarde, Ernest Rutherford, nacido en Nueva Zelanda y exalumno de Thomson, desafió esta representación del átomo cuando descubrió en experimentos que debe tener un pequeño núcleo con carga positiva en su centro.
El átomo ya no consistía simplemente en electrones que flotaban en una sopa, sino que tenía un pequeño núcleo central que contenía la mayor parte de la masa
Basándose en este hallazgo, desarrolló un nuevo modelo: el modelo de Rutherford. De acuerdo con éste, el átomo ya no consistía simplemente en electrones que flotaban en una sopa, sino que tenía un pequeño núcleo central que contenía la mayor parte de la masa. Alrededor de este núcleo, los electrones giraban de manera similar a los planetas que orbitan alrededor del sol en nuestro sistema solar, según Britannica.
Algunas preguntas, sin embargo, quedaron sin respuesta. Por ejemplo, ¿cómo era posible que los electrones no colapsaran sobre el núcleo, ya que su carga opuesta significaría que deberían ser atraídos por él? Varios físicos intentaron responder a esta pregunta, incluido el alumno de Rutherford, Niels Bohr.

Niels Bohr y la teoría cuántica
Bohr fue el primer físico en observar la teoría cuántica entonces emergente para tratar de explicar el comportamiento de las partículas dentro del más simple de todos los átomos; el átomo de hidrógeno. Éste consiste en un núcleo pesado con un protón cargado positivamente alrededor del cual orbita un solo electrón, mucho más pequeño y liviano, cargado negativamente. Todo el sistema se parece un poco al Sol con un solo planeta orbitándolo.
Bohr trató de explicar la conexión entre la distancia del electrón al núcleo, la energía del electrón y la luz absorbida por el átomo de hidrógeno, utilizando una gran novedad de la física de la época: la constante de Planck.
La constante de Planck fue el resultado de la investigación del físico alemán Max Planck sobre las propiedades de la radiación electromagnética de un hipotético objeto perfecto llamado cuerpo negro
La constante de Planck fue el resultado de la investigación del físico alemán Max Planck sobre las propiedades de la radiación electromagnética de un hipotético objeto perfecto llamado cuerpo negro.
Extrañamente, el científico descubrió que esta radiación, incluida la luz, no se emite en un continuo sino en paquetes discretos de energía que solo pueden ser múltiplos de un cierto valor fijo, según Physics World. Ese valor fijo se convirtió en la constante de Planck.
¿Qué papel juega la constante de Planck en el átomo de hidrógeno? A pesar de la buena comparación, el átomo de hidrógeno no es exactamente como el sistema solar. El electrón no orbita alrededor de su sol, el núcleo, a una distancia fija, pero puede saltar entre diferentes órbitas según la cantidad de energía que transporta, postuló Bohr. Puede orbitar a la distancia de Mercurio, luego saltar a la Tierra, luego a Marte.
Bohr creía que había un número fijo de órbitas en las que podía viajar el electrón. Cuando éste absorbe energía, salta a una capa orbital más alta. Cuando pierde energía, al irradiarla, cae a una más baja. Si el electrón alcanza la capa orbital más alta y continúa absorbiendo energía, saldrá volando del átomo por completo.
Usando su modelo, Bohr pudo calcular las líneas espectrales, las líneas en el espectro continuo de luz, que absorberían los átomos de hidrógeno.
Las deficiencias del modelo de Bohr
El modelo de Bohr parecía funcionar bastante bien para átomos con un solo electrón. Pero, aparte del hidrógeno, todos los demás átomos de la tabla periódica tienen más, algunos muchos más, electrones que orbitan alrededor de sus núcleos. Por ejemplo, el átomo de oxígeno tiene ocho electrones, el átomo de hierro tiene 26 electrones.
Una vez que Bohr intentó usar su modelo para predecir las líneas espectrales de átomos más complejos, los resultados se volvieron progresivamente sesgados.
Hay dos razones por las que el modelo de Bohr no funciona para átomos con más de un electrón, según el Chemistry Channel. Primero, la interacción de múltiples átomos hace que su estructura energética sea más difícil de predecir. Tampoco tuvo en cuenta algunos de los principios clave de la física cuántica, sobre todo el hecho extraño y alucinante de que las partículas también son ondas, según el sitio web educativo Khan Academy.
Es imposible determinar con precisión la velocidad y la posición de un electrón en cualquier momento
Como resultado de la mecánica cuántica, el movimiento de los electrones alrededor del núcleo no se puede predecir con exactitud. Es imposible determinar con precisión la velocidad y la posición de un electrón en cualquier momento. Las capas en las que orbitan no son, por tanto, simples líneas, sino nubes difusas y menos definidas.
Solo unos años después de la publicación del modelo, los físicos comenzaron a mejorar el trabajo de Bohr, basándose en los principios recién descubiertos del comportamiento de las partículas. Finalmente, surgió el modelo de mecánica cuántica mucho más complicado, que reemplazó al modelo de Bohr. Pero, debido a que las cosas se vuelven mucho menos claras cuando todos los principios cuánticos están en su lugar, el modelo de Bohr es probablemente lo primero que la mayoría de los estudiantes de física descubren en su búsqueda por comprender qué gobierna la materia en el micromundo.
Fuente: Space.com.








